常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是确定的致癌、致畸形物之一.我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m
3.某同学设计测定甲醛的方法如下(假设空气中无其它还原性气体):
(1)测定原理:KMnO
4(H
+)溶液为强氧化剂,可氧化甲醛和草酸,化学反应离子方程式为:4MnO
4-+5HCHO+12H
+═4Mn
2++5CO
2↑+11H
2O
2MnO
4-+5H
2C
2O
4+6H
+═2Mn
2++10CO
2↑+8H
2O
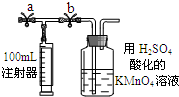
(2)测定装置:部分装置如图所示(a、b为止水夹)
(3)实验步骤:
①用
(填仪器名称)准确移取25.00mL 1.00×10
-3mol?L
-1的KMnO
4溶液(过量)于广口瓶中并
滴入3滴6mol?L
-1H
2SO
4溶液备用;
②将2.00×10
-3mol?L
-1的草酸标准溶液置于
(填仪器名称)中备用;
③于装修完工后的第30天取样:打开a,关闭b,用注射器抽取100mL新装修的室内空气.关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应.再如此重复4次(共5次).如果压送气体时速度过快,可能会产生的不利后果是
;
④将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶).如果没有润洗,所测甲醛的含量将
(填“偏高”、“偏低”、“无影响”);
⑤用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积.本实验
(填:需要、不需要)指示剂.
⑥再重复实验2次.
(4)数据处理:设 KMnO
4溶液的物质的量浓度为c
1,KMnO
4溶液的体积为V
1(mL);草酸溶液的物质的量浓度为c
2,草酸溶液的平均体积为V
2(mL)则:计算室内空气中甲醛浓度(mg/m
3)的代数式为
(用c
1、c
2、V
1、V
2表示);
照上述方法实验平均消耗草酸30.79mL.计算第30天室内空气中甲醛浓度为
mg/m
3(精确到小数点后二位),并判断此时主人
(填:能或不能)入住.

 常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是确定的致癌、致畸形物之一.我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3.某同学设计测定甲醛的方法如下(假设空气中无其它还原性气体):
常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是确定的致癌、致畸形物之一.我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3.某同学设计测定甲醛的方法如下(假设空气中无其它还原性气体):







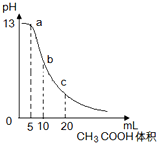 25℃时,向体积为10mL0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是( )
25℃时,向体积为10mL0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如图所示,有关离子浓度关系的比较中,错误的是( )