
题目列表(包括答案和解析)
 (2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:| C(H2)?C(CO) |
| C(H2O) |
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性?????? (填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是?????????????????????????? ;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为??????????? mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。

请回答下列问题:
(1)A的电子式为???????? D的化学式?????????? ,C溶液的名称是??????????????????? 。
(2)反应①的化学方程式为?????????????????????????????? ;
反应③的离子方程式为?????????????????????????????????? 。
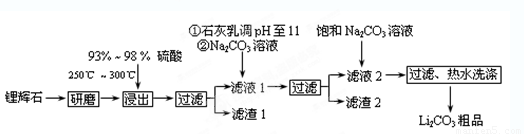
(12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:① Li2O·Al2O3·4SiO2
+H2SO4(浓)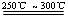 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。
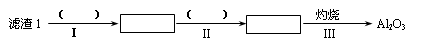
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
② b中,生成Li2CO3反应的化学方程式是______________________________。
用适当溶液把3.31 g某铁矿石样品溶解,然后加过量碱溶液,生成沉淀,再灼烧沉淀,得2.40 g Fe2O3。已知该铁矿石中铁的氧化物的质量分数为70.0%。试计算:
⑴ 该铁矿石中铁的质量分数。 ⑵ 该铁矿石中铁的氧化物的化学式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com