
题目列表(包括答案和解析)
| A、一定温度下,反应Mg(1)+Cl2(g)=MgCl2(1)的△H<0,△S<0 | ||||||||||||
| B、101 kPa时,硫的标准燃烧热与硫完全燃烧时物质的量有关 | ||||||||||||
C、通常人们把拆开1 mol气态物质中某种共价键需要吸收的能量看成该共价键的键能
| ||||||||||||
| D、已知:N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1 2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1 C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1 则4CO(g)+2NO2(g)=4NO2(g)+N2(g)△H=+1200kJ?mol-1 |
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC_________Si;SiCl4_____________SiO2
(2)图3-9中立方体中心的“·”表示硅晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的硅原子。
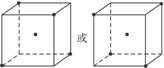
图3-9
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH_______=kJ·mol-1
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
下列叙述正确的是( )
A.由于Si-C的键能大于Si-Si的键能,所以SiC的熔点高于晶体硅的熔点
B.由于Si-O的键能大于Si-Cl的键能,所以SiO2的熔点低于晶体SiCl4的熔点
C.SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(4×176 kJ·mol-1-4×431 kJ·mol-1)
Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(4×176 kJ·mol-1-4×431 kJ·mol-1)
D.SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(2×176 kJ·mol-1-4×431 kJ·mol-1)
Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(2×176 kJ·mol-1-4×431 kJ·mol-1)
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
|
化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H为( )
Si(s)+4HCl(g),该反应的反应热△H为( )
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则下列热化学方程式不正确的是
A.![]() H2(g)+
H2(g)+![]() Cl2(g)
Cl2(g)![]() HCl(g);ΔH=-91.5 kJ·mol-1
HCl(g);ΔH=-91.5 kJ·mol-1
B.![]() H2(g)+
H2(g)+![]() Cl2(g)
Cl2(g)![]() HCl(g);ΔH=+91.5 kJ·mol-1
HCl(g);ΔH=+91.5 kJ·mol-1
C.H2(g)+Cl2(g)![]() 2HCl(g);ΔH=-183 kJ·mol-1
2HCl(g);ΔH=-183 kJ·mol-1
D.2HCl(g)![]() H2(g)+Cl2(g);ΔH=+183 kJ·mol-1
H2(g)+Cl2(g);ΔH=+183 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com