
题目列表(包括答案和解析)

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的 pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
| ||
| ||



据报道, 有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐:
4CuFeS2 + 2H2SO4 + 17O2 = 4CuSO4 + 2Fe2(SO4)3 + 2H2O
(1) 利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
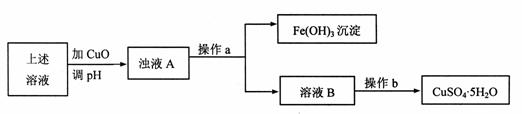
①溶液B显 (填“酸”、“碱”或“中”)性,原因是 (用离子方程式表示)。
②分析下表所提供的数据可知,加入CuO可除去CuSO4溶液中的Fe3+。
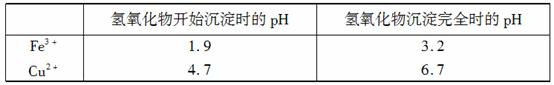
请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因:
③操作a的名称是 ,操作b的操作方法是 。
④检验溶液B中Fe3+是否被除尽的试剂是 ,证明Fe3+已被除尽的现象是 。
(2)在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:
方案一:
方案二:
(8分)卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁的工艺流程如下:
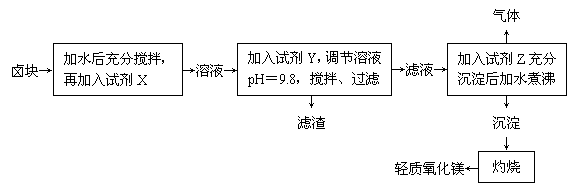
若要求产品中尽量不含有杂质,且生产成本较低,请根据下表中提供的资料,回答下列问题:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀时的pH | 沉淀完全时的pH |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Fe2+氢氧化物呈絮状,不易从溶液中除去,故常将它氧化成Fe3+,生成Fe(OH)3沉淀除去。
表2 原料价格表
物质 | 价格/元?吨-1 |
漂液(含25%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
⑴试剂X最好是 ,加入X的作用是 。
⑵调节pH=9.8的目的是 。
⑶加入试剂Z后发生的离子反应方程式为 。
⑷ 生产中产生的气体是CO2,写出产生CO2的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com