
题目列表(包括答案和解析)
(1)请写出希尔实验反应的离子方程式_____________________;检验Fe3+已经全部转变成Fe2+的方法是____________________________________________________________。
(2)若能在实验室模拟光合作用的过程,请你设计出证实O2来源的方法是________________
____________________________________________________________________。
(3)人类使用的能源大部分来源于太阳能,能捕获太阳能的生物主要是绿色植物,光合作用的总的化学反应式_________________________________________________________________。
(4)葡萄糖是一种重要的营养物质,它是人类生命活动所需能量的重要来源之一,若
(5)在医疗上检查病人是否患糖尿病时,是取病人的尿液与___________共热,看是否有_________色沉淀生成,该反应的化学方程式_____________________________________。
(6)临床上可使用一种生物制剂来治疗糖尿病,该生物剂的名称是___________,它的治疗原理是加速组织细胞对血糖的___________,加速糖元的___________,从而达到___________的目的,在临床治疗时只能注射而不能口服,原因是_________________________________。
 含放射性的131I的碘〔131I〕化钠口服溶液在临床医学上常用于治疗甲亢.某碘〔131I〕化钠口服溶的说明书摘录(部分)如图,按要求回答下列问题.
含放射性的131I的碘〔131I〕化钠口服溶液在临床医学上常用于治疗甲亢.某碘〔131I〕化钠口服溶的说明书摘录(部分)如图,按要求回答下列问题.
 含放射性的131I的碘〔131I〕化钠口服溶液在临床医学上常用于治疗甲亢.某碘〔131I〕化钠口服溶的说明书摘录(部分)如图,按要求回答下列问题.
含放射性的131I的碘〔131I〕化钠口服溶液在临床医学上常用于治疗甲亢.某碘〔131I〕化钠口服溶的说明书摘录(部分)如图,按要求回答下列问题.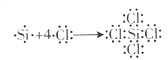
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com