
题目列表(包括答案和解析)
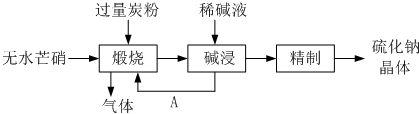
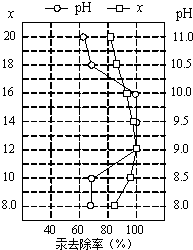 (4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是 【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |

 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
水煤气法制甲醇工艺流程框图如下
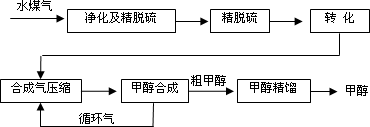
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),
CO(g)+H2(g),
②下列能增大碳的转化率的措施是________;(填字母代号)
A.加入
C(s)B.
加入H2O(g)C.升高温度
D.增大压强
(2)合成气经压缩升温后进入10 m3甲醇合成塔,在催化剂作用下,进行甲醇合成,
主要反应如下:2H2(g)+CO(g)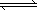 CH3OH(g);ΔH=-90.8 kJ·mol-1,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH=-90.8 kJ·mol-1,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
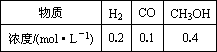
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”).
②若加入CO、H2后,在T5℃反应10 min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH)=________mol-1·(Lmin)-1.
(3)生产过程中,合成气要进行循环,其目的是________.
(1)在常温下,可以用银氨溶液来检测微量的CO,其原理与银镜反应相似,有银析出。写出银氨溶液与CO反应的化学方程式________________________。
(2)工业上常采用甲烷化法除去少量碳的氧化物(CO、CO2)。其方法是:一定温度时,在催化剂的作用下,向碳的氧化物中通入氢气,使之转化为甲烷和易于除去的水。写出CO发生甲烷化反应的化学方程式________________。
(3)在上述两个反应中,CO依次作________,________。
A.氧化剂
B.既是氧化剂,又是还原剂
C.还原剂
D.既不是氧化剂,又不是还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com