[选做题](1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程.目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论.
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论.溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱.试写出液氨自身电离的方程式:
2NH3=NH4++NH2-
2NH3=NH4++NH2-
.
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论.凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱.
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是
AD
AD
.
A、H
2O B、NH
4+ C、OH
- D、HCO
3- E、CH
3COO
- F、Cl
-③1923年路易斯(Lewis)提出广义的酸碱概念.凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸.
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H
++OH
-→H
2O.
试指出下列两个反应中的酸或碱:
(Ⅰ)H
3BO
3+H
2O

H
++B(OH)4
-,该反应中的碱是
H2O
H2O
(填H
3BO
3或H
2O);
(Ⅱ)NaH+H
2O═NaOH+H
2↑,该反应中的酸是
H2O
H2O
(填NaH 或H
2O).
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满.D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nS
nnP
n+1.按要求填写
①B的电子排布式是:
1s22s22p63s23p5
1s22s22p63s23p5
,A、B两元素形成的化合物的晶体类型是
离子晶体
离子晶体
.
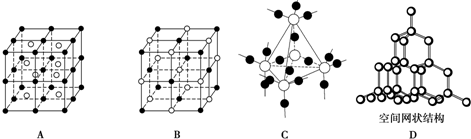
②D元素单质的晶体类型是
原子晶体
原子晶体
,C单质的制备方法是:
电解法
电解法
.
③E和F形成的化合物空间构型为
三角锥型
三角锥型
,该物质比D与E形成的化合物更容易液化的原因是
E和F形成的化合物分子间能形成氢键
E和F形成的化合物分子间能形成氢键
.

 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是