
题目列表(包括答案和解析)
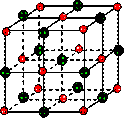
在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
①在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有 个。
每个Na+离子周围与它最接近的、且距离相等的Na+共有 个。而Na+离子数目与Cl-离子数目之比为 。
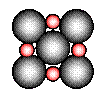
②在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。
![]()
|
a
(1) (2) (3)
③试回答下列问题:
NaCl晶体中离子键的键长为 。Na+离子半径与Cl-离子
半径比r+/r- = 。(已知 √2=1.414 , √3=1.732, √5=2.236)
④NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为 。
⑤纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为 。
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
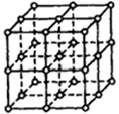
(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有 个。
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为 cm。计算过程如下:
(10分)如图所示:已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。甲池是 装置,乙池是 装置。
(2)B(石墨)电极的名称是 。在图中标明电子移动的方向。
(3)通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)

图3-15
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有_____________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上,面上,棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于_____________,即_____________(填计算式);Na+的个数等于_____________,即_____________(填计算式)。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为_____________cm。
如图,直线交点处的圆圈为NaCl晶体中Na+和Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
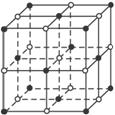
(1)请将其中代表Na+的圆圈涂黑(不考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+周围与它最接近的且距离相等的Na+共有( )
A.4个 B.6个 C.8个 D.12个
(3)晶体中,与每个Na+距离相等且距离最近的n个Cl-所围成的空间几何构型为( )
A.正四面体 B.正六面体
C.正八面体 D.正二十面体
(4)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________个,即________(填计算式),Na+的个数等于___________,即________________________________(填计算式)。
(5)设NaCl的摩尔质量为M g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA。食盐晶体中两个距离最近的Na+中心的距离为___________cm。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com