
题目列表(包括答案和解析)

 某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.
某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. | 有________生成,滤液为蓝色 |


某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分
解反应进行再探究。
 【查阅资料】大多数强酸、强碱和盐类物质溶解于水时,在水
【查阅资料】大多数强酸、强碱和盐类物质溶解于水时,在水
分子的作用下发生了电离,产生了能够自由移动的阴、
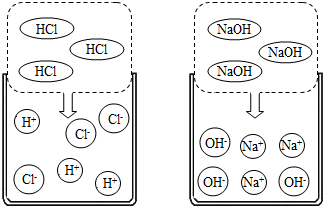
阳离子。如图是HCl和NaOH在水中解离出离子的示意
图,HCl在水中会解离出H+和Cl-,NaOH在水中会解离
出Na+和OH-。以此类推,AgNO3在水中会解离出的离
子是 ▲ 和 ▲ (填离子符号)。
【提出问题】如何证明稀盐酸和氢氧化钠溶液发生反应了呢?
【实验设计】
| 实验步骤 | 实验现象 | 实验结论 |
| ▲ | ▲ | ▲ |
【反思质疑1】溶液中的离子都参加反应了吗?
【实验设计】
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液。 | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液。 | 有 ▲ 生成,滤液为蓝色 |
【得出结论】通过对上述实验现象的分析,我们可以得出这样的结论:CuSO4溶液和
BaCl2溶液反应,实质参加反应的是Ba2+和SO42-,它们结合生成BaSO4沉淀,而
Cl-和Na+则是旁观者,并没有参加反应。
【反思质疑2】反应前后单位体积的溶液中能够自由移动的离子的数目有无改变?
 【研究讨论】稀盐酸与氢氧化钠溶液的反应我们可以用下图表示:
【研究讨论】稀盐酸与氢氧化钠溶液的反应我们可以用下图表示:
 |
 请你在下图圆圈中▲处将BaCl2溶液和CuSO4溶液反应的产物补充完整:
请你在下图圆圈中▲处将BaCl2溶液和CuSO4溶液反应的产物补充完整:
 |
【表达交流】通过上述探究我们可以得出酸碱盐在溶液中发生复分解反应的实质是:
| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. | 有______生成,滤液为蓝色 |



| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. | 有______生成,滤液为蓝色 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com