
题目列表(包括答案和解析)
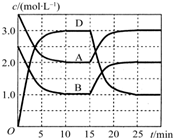 温度为T时,向2V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向2V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )| A、反应在前10min的平均反应速率v(D)=0.15mol?L-1?min-1 | ||
B、该反应的平衡常数表达式K=
| ||
| C、若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | ||
| D、反应至15min时,改变的条件是降低温度 |
(1)下列方法可以证明2HI(g)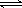 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)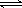 2SO3(g)。研究发现,
2SO3(g)。研究发现,
SO3的体积分数(SO3%)随温度(T)的变化如上图所示:
下列判断正确的是
A. 该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
(1)下列方法可以证明2HI(g)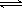 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)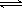 2SO3(g)。研究发现,
2SO3(g)。研究发现,
SO3的体积分数(SO3%)随温度(T)的变化如上图所示:
下列判断正确的是
A. 该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g) 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)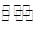 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
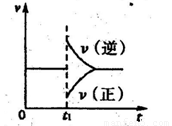
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中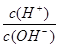 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 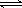 2SO3(g)。研究发现,
2SO3(g)。研究发现,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com