采用硫酸同槽浸出软锰矿(主要成分MnO
2)和黄铜矿(主要成分CuFeS
2)的新工艺方法提取锰、铜、铁元素获得成功,符合绿色化学思想,生产流程示意如下:已知:
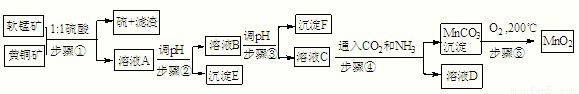
步骤①:5MnO
2+2CuFeS
2+10H
2SO
4=5MnSO
4+Fe
2(SO
4)
3+2CuSO
4+4S+10H
2O
(1)请写出MnO
2一种用途:______.
根据下表数据,回答相关问题.
| Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(2)E:______,F:______,D中主要溶质______(填化学式).
(3)若c(MnSO
4)=3×10
-6 mol?L
-1,c(CO
32-)=3.3×10
-5 mol?L
-1,则MnSO
4溶液与碳酸盐溶液按体积比2:1混合,恰好达到溶解平衡,MnCO
3的K
sp=______.
(4)请写出步骤④发生的离子反应方程式:______.
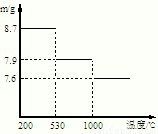
(5)步骤⑤,在不同温度下分解可得到锰的不同氧化物.根据如图数据计算:530℃至1000℃时,可得一种固体纯净物.其化学式为:______.
(6)称取0.435g软锰矿于烧杯中,再分别往烧杯中加入过量的20.00mL 0.1000mol?L
-1 Na
2C
2O
4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol?L
-1的KMnO
4溶液滴定至终点,消耗了4.00mL KMnO
4的溶液.反应式如下:MnO
2+Na
2C
2O
4+2H
2SO
4=MnSO
4+Na
2SO
4+2CO
2↑+2H
2O
①写出酸性KMnO
4溶液滴定剩余Na
2C
2O
4溶液的离子反应方程式:______.
②计算软锰矿中MnO
2的百分含量______.


