
题目列表(包括答案和解析)
| |||||||||||||||
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)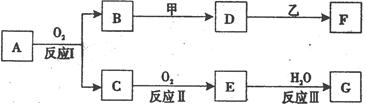
(1)第一种情况:A为气体;用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
① B与甲反应的化学方程式为____________________ ___________________。
② D与乙反应的离子方程式为__________________________ _________。
(2)第二种情况:A为黄色固体;甲可由两种单质直接化合得到; D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
① 工业上,反应 I 在___________________(填设备名称)中进行。
② 甲的化学式为______________。
③ D和乙反应的离子方程式为______________________ _________。
④ 请简述检验G溶液中阴离子的方法
⑤ 若A的相对分子质量为M,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数= (列出计算式即可)。
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
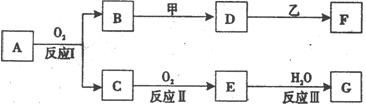
(1)第一种情况:A为气体;用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
① B与甲反应的化学方程式为____________________ ___________________。
② D与乙反应的离子方程式为__________________________ _________。
(2)第二种情况:A为黄色固体;甲可由两种单质直接化合得到; D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
① 工业上,反应 I 在___________________(填设备名称)中进行。
② 甲的化学式为______________。
③ D和乙反应的离子方程式为______________________ _________。
④ 请简述检验G溶液中阴离子的方法
⑤ 若A的相对分子质量为M,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数= (列出计算式即可)。
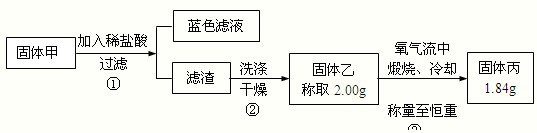
开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=??????? ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA???? tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:???????????????????????????????????? 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是????????? ? ,曲线Ⅱ对应的实验条件改变是??????? 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]

①下列说法中正确的是????? 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是????? (填晶体类型)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com