
题目列表(包括答案和解析)
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
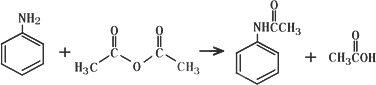
实验步骤:
①取5.0 mL苯胺(密度1.04 g/mL),倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.0 mL乙酸酐(密度1.08 g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150 mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)步骤①研碎块状产物的用意在于________;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有________.
A、反应快结束时的充分搅拌
B、旋摇下分批加入6.0 mL乙酸酐
C、玻璃棒将块状物研碎
D、加20 ml水
(2)步骤②洗涤粗产品时,选用的溶剂是________.
A、热水
B、冷水
C、1∶3乙醇溶液
D、滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择________(填“过滤”、“趁热过滤”或“抽滤”);配制热溶液时,加入过量溶剂的作用是________(选出正确选项);;
A、防止后续过程中,溶剂损失可能产生的产物析出
B、防止后续过程中,温度降低可能产生的产物析出
C、除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时选择在室温下自然冷却,若选择在冰水浴中冷却会使得到的沉淀颗粒太小,则进行抽滤操作时会________;
(5)步骤③中以下哪些操作不能提高产率________.
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体
A、①④⑤
B、①④
C、④⑤
D、②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75 g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93 g/mol、102 g/mol、135 g/mol.该实验的产率为________(保留两位有效数字)


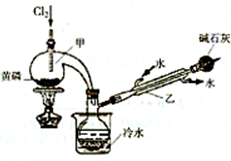
 甲、乙、丙、丁是原子序数不超过20的元素组成的物质(单质或化合物),且存在如下转化关系:甲+乙一丙+丁.依次回答下列问题:
甲、乙、丙、丁是原子序数不超过20的元素组成的物质(单质或化合物),且存在如下转化关系:甲+乙一丙+丁.依次回答下列问题:| 熔点/℃ | 沸点/℃ | 密度/g?mL | 其他 | |||||||||
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2
2P+5Cl2(过量)
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于 PCl3 |
| ||
| ||
(c1V1-
| ||
| m |
(c1V1-
| ||
| m |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com