
题目列表(包括答案和解析)
(6分)已知A、B、C、D分别是由短周期元素原子组成的四种微粒,它们之间有如图所示的转变关系,且A是种含有18电子的微粒,C是一种含有10电子的微粒。请完成下列各题:
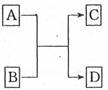
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程
式
(2)若B、D属同主族的单质分子,写出C的化学式
(3)若B是一种含四核l8电子的分子,如果D是一种气态单质分子,B的结构简式为 ;
(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为
(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有 (写出物质的化学式,如果是有机物则写相应的结构简式)。
(8分)已知:A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=________。酸碱按体积比为1 ∶10混合后溶液显中性,则a+b=________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为________mol·L-1,B溶液中水电离出的氢离子浓度为________mol·L-1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系为VA________VB(填“>”、“<”或“=”,下同),混合后溶液中的离子浓度关系为c(Na+)________
c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(10分)已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。

(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式 。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 ,B在反应中表现出的性质是 、 。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式 ;实验室检验C的方法 。
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)
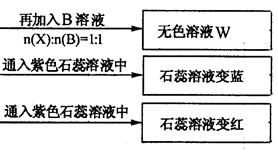
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
(10分)已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。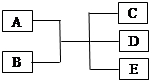
(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式 。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 ,B在反应中表现出的性质是 、 。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式 ;实验室检验C的方法 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com