
题目列表(包括答案和解析)
(9分) 向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。
一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。

(1)若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=________。
(2)t4-t5阶段改变的条件为________,B的起始物质的量为________。各阶段平衡时对应的平衡常数如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1=________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________(用“>”“<”或“=”连接)。
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:________________________。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为________。
(1) 反应: 2A(g) B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
(2) 在容积相同的两密闭容器A和B中, 保持温度为 423K, 同时向A和B中分别加入 a mol 和 b mol 的HI(a > b), 待反应: 2HI(g) H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
从反应开始到达到平衡所需要时间: tA _______ tB(填>,<, =", " 下同)
平衡时的碘的浓度: c(I2 )A c(I2 )B
HI的平衡分解百分率为:  .
.
下列是酸溶液与碱溶液发生反应的各种关系,请用“>”“<”或“=”填空:
(1) 取0.2 mol/LHX溶液与0.2 mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(X-)。
①混合溶液中c(HX) c(X-);
②混合溶液中c(HX) + c(X-) 0.1 mol/L(忽略溶液体积变化);
③混合溶液中由水电离出的c(OH-) 0.1 mol/L 的HX溶液中由水电离出的c(H+)。
(2) 如果取0.2 mol/LHX溶液与0.1 mol/LNaOH溶液等体积混合,测得混合溶液的PH>7,则说明在相同浓度时HX的电离程度 NaX的水解程度。
(3) 分别取pH=2的硫酸和醋酸各50mL,加入足量的镁粉,反应开始时,反应速率前者_________后者;充分反应后,相同条件下产生氢气的体积前者_________后者。
(4) 等浓度等体积的盐酸和醋酸,分别与等浓度的NaOH溶液反应,恰好中和时,消耗NaOH的体积前者__________后者,所得溶液的pH前者________后者。
(1) 反应: 2A(g) B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x 的值为 __________.
(2) 在容积相同的两密闭容器A和B中, 保持温度为 423K, 同时向A和B中分别加入 a mol 和 b mol 的HI(a> b), 待反应: 2HI(g)H2(g)+ I2(g)到平衡后, 用 “ > < 或 =”回答下列问题:
从反应开始到达到平衡所需要时间: tA _______ tB(填>,<, =, 下同)
平衡时的碘的浓度: c(I2 )A c(I2)B
HI的平衡分解百分率为:  .
.
(10分) 向容积为2L的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图1所示。图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c(B)未画出。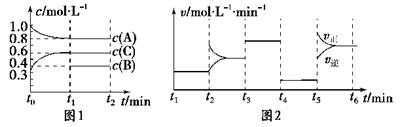
(1) 若t1=15 min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2) t4-t5阶段改变的条件为 ,B的起始物质的量为 。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com