
题目列表(包括答案和解析)
氧化铜是一种黑色粉末,其制品除在烟花中使用外还可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂。为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源回收再利用,减少污染。
(1)获得硫酸铜
该小组同学利用H2O2和H2SO4混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜。
写出该反应的化学方程式 。
(2)制备氧化铜

①步骤I的目的是除去可溶性杂质;
②步骤II的目的是得到CuSO4·5H2O固体。该步骤操作是 、 、过滤、水浴加热烘干。水浴加热的特点是 。
(3)探究氧化铜是否能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表:
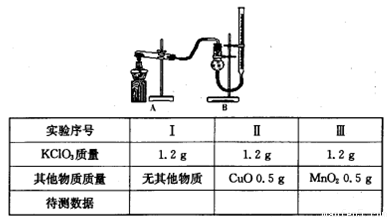
回答下列问题:
①上述实验中的“待测数据”指 。
②若要证明实验II中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞, 。
③为探究CuO在实验III中是否起催化作用,需补做如下实验(无需写出具体操作):
a.CuO的化学性质有没有改变;b 。.
氧化铜是一种黑色粉末,其制品除在烟花中使用外还可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂。为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源回收再利用,减少污染。
(1)获得硫酸铜
该小组同学利用H2O2和H2SO4混合溶液可溶出印刷电路板金属粉末中的铜,从而获得硫酸铜。
写出该反应的化学方程式 。
(2)制备氧化铜
①步骤I的目的是除去可溶性杂质;
②步骤II的目的是得到CuSO4·5H2O固体。该步骤操作是 、 、过滤、水浴加热烘干。水浴加热的特点是 。
(3)探究氧化铜是否能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。用如图装置进行实验,实验时均以收集25mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表: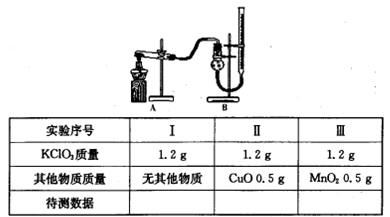
回答下列问题:
①上述实验中的“待测数据”指 。
②若要证明实验II中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞, 。
③为探究CuO在实验III中是否起催化作用,需补做如下实验(无需写出具体操作):
a.CuO的化学性质有没有改变;b 。.

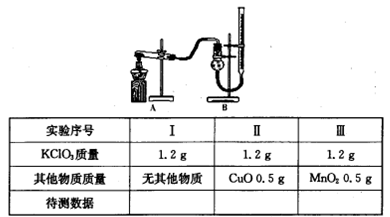
某化学兴趣小组欲证明氧化铜也能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较,用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略。相关数据见下表:

实验编号 | KClO3质量 | 其它物质质量 | 待测数据 |
A | 1.2g | 无其它物质 |
|
B | 1.2g | CuO 0.5g |
|
①上述实验中的“待测数据”指 ;
②根据实验目的,还需增加一个实验C,请在下表空格中填入相关内容。
实验编号 | KClO3质量 | 其它物质质量 | 待测数据 |
C |
|
| ―― |
③该小组学生在连接好实验装置后,进行装置的气密性检查,先往b处加适量水,使a、b两边液面相平,然后在试管处用酒精灯加热,发现b处液面上升,移开酒精灯后冷却到原温度,发现两边液面又相平,由此断定,该装置的气密性良好。你认为他们的操作可行吗?请说明理由。 。
(一)氧化铜的制备:
①称取
②向上述溶液中逐滴加入NaOH溶液,直至不再产生沉淀,将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色。
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
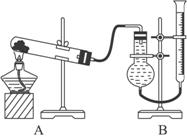
(二)证明氧化铜能加快氯酸钾分解并与MnO2的催化效果比较:
用如上图装置进行实验,所能影响实验的其他因素均已忽略,实验数据如下表:
实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
④ | 无其他物质 | x | |
⑤ | CuO | y | |
⑥ | MnO2 | z |
试回答如下问题:
(1)上述实验各步骤中需要使用玻璃棒的是________ (填序号)。步骤①③中研磨固体所使用仪器名称是__________________________________________________________________。
(2)步骤③中洗涤沉淀的操作是________________________________________________。
(3)上述实验装置图中量气装置B是由干燥管、乳胶管和50 mL滴定管改造组装而成,此处的滴定管是________ (填“酸式”或“碱式”)滴定管。
(4)除测定出表中“待测数据”外,为探究CuO在实验⑤中是否起催化作用,需补做如下实验(具体操作不需写出)。
a.________;b.CuO的化学性质有没有改变。
(5)表中的“待测数据”x、y、z指________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com