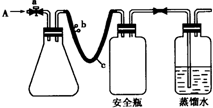
(2012?南通模拟)实验室用下列方法测定某水样中O
2的含量.
(1)实验原理
用如图所示装置,使溶解在水中的O
2在碱性条件下将Mn
2+氧化成MnO(OH)
2,反应的离子方程式为
2Mn2++O2+4OH-=2MnO(OH)2
2Mn2++O2+4OH-=2MnO(OH)2
.再用I
-将生成的MnO(OH)
2还原为Mn
2+,反应的离子方程式为:MnO(OH)
2+2I
-+4H
+=Mn
2++I
2+3H
2O.然后用Na
2S
2O
3标准溶液滴定生成的I
2,反应方程式为:I
2+2Na
2S
2O
3=2NaI+Na
2S
4O
6.
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N
2,此操作的目的是
赶走装置内空气,避免空气中的O2的干扰
赶走装置内空气,避免空气中的O2的干扰
;
②用注射器抽取某水样20.00mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO
4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液,并用稀H
2SO
4溶液调节pH至接近中性;
⑥
重复④的操作
重复④的操作
;
⑦取下锥形瓶,向其中加入2~3滴
淀粉溶液
淀粉溶液
作指示剂;
⑧用0.005mol?L
-1Na
2S
2O
3 滴定至终点.
(3)数据分析
①若滴定过程中消耗的Na
2S
2O
3 标准溶液体积为3.90mL,则此水样中氧(O
2)的含量为
7.8mg?L-1
7.8mg?L-1
(单位:mg?L
-1).
②若未用Na
2S
2O
3 标准溶液润洗滴定管,则测得水样中O
2的含量将
偏大
偏大
(填“偏大”、“偏小”或“不变”).
③步骤⑤中加入适量的H
2SO
4使溶液接近中性,其原因是
加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液偏大
加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液偏大
.

 (2012?南通模拟)实验室用下列方法测定某水样中O2的含量.
(2012?南通模拟)实验室用下列方法测定某水样中O2的含量.