
题目列表(包括答案和解析)
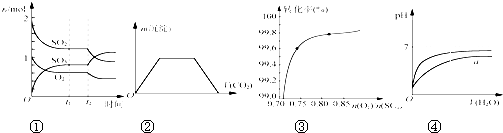
A、图①表示一定条件下进行的反应2SO2+O2
| |||
| B、图②表示向Ba(OH)2、KAlO2混合溶液中通入CO2 | |||
C、如图③在其他条件不变时,2SO2(g)+O2(g)
| |||
| D、图④表示pH相同的盐酸与醋酸中分别加入水后pH的变化,其中曲线a对应的是盐酸 |

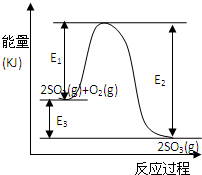 T℃时反应2SO2(g)+O2(g)
T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题.
2SO3(g)过程中的能量变化如图所示,回答下列问题. 2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol 2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com