
题目列表(包括答案和解析)

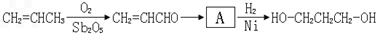
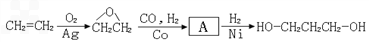
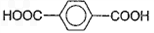 )为原料可以合成聚酯PTT,写出其化学方程式 ______________。
)为原料可以合成聚酯PTT,写出其化学方程式 ______________。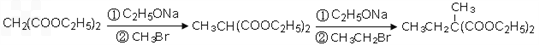
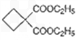 ,再转化为
,再转化为 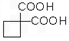 。
。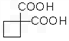 的同分异构体不可能属于__________。
的同分异构体不可能属于__________。  ,必须先合成哪些物质?(用合成该物质的化学方程式回答) __________。
,必须先合成哪些物质?(用合成该物质的化学方程式回答) __________。
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B. c(HA-)+c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP=4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
(4分)选择下列实验方法分离物质,将分离方法的序号填在横线上:
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
(1) 分离水和四氯化碳的混合物;
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3) 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(4) 从碘水中提取碘单质。
(6分)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H= 。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
A.1∶1 B.1∶3 C.1∶4 D.2∶3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com