
题目列表(包括答案和解析)
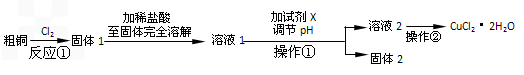
某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O).
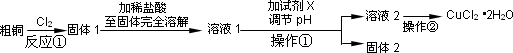
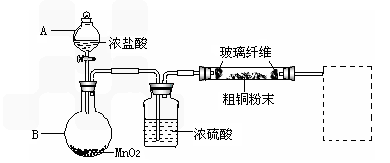
(1)实验室采用如下图所示的装置,可将反应①粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
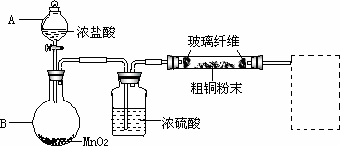
①仪器A的名称是________.
②连接好装置后,加入药品前,应该进行的实验操作是________.
③装置B中发生反应的离子方程式是________.
④有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要
(填“是”或“否”)________.
⑤虚线内缺少实验装置,请你画出装置图,标明药品名称.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)________.
a.NaOH
b.NH3·H2O
c.CuO
d.Cu2(OH)2CO3
e.CuSO4
操作①的名称是________.
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小
组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
![]()
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)________.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
(4)操作②需在氯化氢气流中经过加热浓缩、________、过滤、洗涤、干燥.
① 仪器A的名称是_________________。
② 连接好装置后,加入药品前,应该进行的实验操作是_______________。
③ 装置B中发生反应的离子方程式是______________。
④ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)________________。
⑤ 虚线内缺少实验装置,请你画出装置图,标明药品名称。
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
操作①的名称是______________。
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+ (aq) +4Cl-(aq) 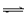 CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)_____________。
a.将Y稀释,发现溶液呈蓝色 b.在Y中加入CuCl2晶体,溶液变为绿色 c.在Y中加入NaCl固体,溶液变为绿色 d.取Y进行电解,溶液颜色最终消失
(4)操作②需在氯化氢气流中经过加热浓缩、__________、过滤、洗涤、干燥。
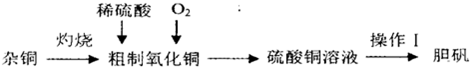
(15分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
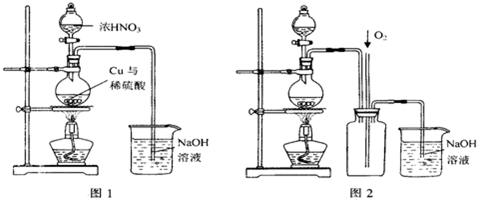
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。
①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com