
题目列表(包括答案和解析)
1998年,美国科学家合成出具有极强爆炸性的“![]() ”,对其结构尚不清楚,只知“
”,对其结构尚不清楚,只知“![]() ”实际是带正电荷的分子碎片.若“
”实际是带正电荷的分子碎片.若“![]() ”的空间结构呈V形对称,5个氮原子最外电子层都达8电子结构,且含2个N≡N,将其视为“
”的空间结构呈V形对称,5个氮原子最外电子层都达8电子结构,且含2个N≡N,将其视为“![]() ”,则n值为
”,则n值为
[ ]
|
设NA为阿伏加德罗常数,下列叙述中正确的是 | |
| [ ] | |
A. |
标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8NA |
B. |
18 g水中含有的电子数为8NA |
C. |
46 g二氧化氮和46 g四氧化二氮含有的原子数均为3NA |
D. |
在1 L 2 mol/L的醋酸钠溶液中含有的醋酸根离子数为2NA |
|
与6 g尿素[CO(NH2)2]含氮物质的量不相同的物质是 | |
| [ ] | |
A. |
3.4 g NH3 |
B. |
0.1 mol NH4NO3 |
C. |
6 g NH4NO3 |
D. |
13.2 g (NH4)2SO4 |
甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题
:(1)
用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知: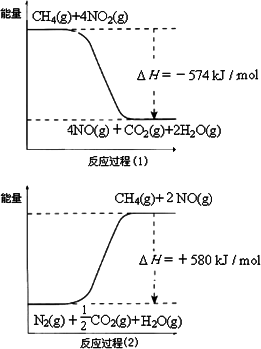
反应过程(2)是________反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是________.
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g) CHCl3(g)+HCl(g),
CHCl3(g)+HCl(g),
在固定容积为2 L的密闭容器中,该反应达到平衡后,测得如下数据:

①此反应在110℃时平衡常数为________.②实验1中,CCl4的转化率为________.
③判断该反应的正反应是________
(填“放热”或“吸热”),理由是_____________.④为提高实验3中CCl4的转化率,可采取的措施是________.
a.使用高效催化剂
b.向容器中再投入1 mol CCl4和1 mol H2
c.温度升高到200℃
d.向容器中再投入1 mol HCl
e.向容器中再投入1 mol H2
最近,科学家合成出具有极强爆炸性的“N5”,对其结构尚不清楚,只知“N5”实际是带正电荷的分子碎片.若“N5”的空间结构呈V形对称,5个氮原子最外电子层都达8电子结构,且含2个N≡N,将其视为“ ”,则n值为
”,则n值为
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com