
题目列表(包括答案和解析)
 某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
(1)若E1>E2,则该反应为_______热反应。该反应的过程可看成是______________。
(2)若E1<E2,则该反应为_______热反应。那么在发生化学反应时,反应物需要_____________才能转化成生成物。该反应过程可看成是_____________________ 。
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。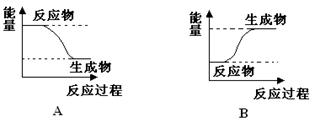
(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B” )表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图__________(填“A”或“B” )表示。
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。

(1)若E1>E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B” )表示。
(2)若E1<E2,则该反应为________(填“放热”或“吸热”)反应。该反应可用图__________(填“A”或“B” )表示。
(1)若E1>E2,则该反应为_____________热反应,该反应的过程可看成是_____________。
(2)若E1<E2,则该反应为_____________热反应。那么在发生化学反应时,反应物需要_____________才能转化成生成物。该反应过程可看成是__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com