
题目列表(包括答案和解析)
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式______________________________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统;
b.对电线、铁轨、桥梁、房屋等均会造成严重损害;
c.破坏臭氧层;
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥。
(2)下图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式____________________________。
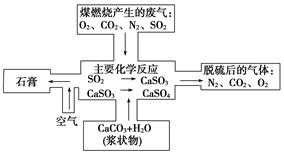
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)________,它对环境的负面影响是______________________________________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是__________________________________。


 Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O______________________________;
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O______________________________;
 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
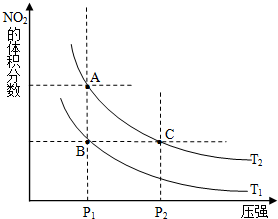
(12分)氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化。
(1)对反应N2O4(g)2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(同上)。
(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 。
②100℃时,反应2NO2(g)N2O4(g)的平衡常数K的值为 。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 。(结果保留小数点后一位)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com