
题目列表(包括答案和解析)
(本题共10分) 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜: 如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。

步骤二:碱式碳酸铜的制备:向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
①.上图装置中NaOH溶液的作用是_ _。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有__ __(填写化学式)。
②步骤二中,水浴加热所需仪器有__ __、_ _(加热、夹持仪器、石棉网除外);
洗涤的目的是__ __。
③.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
④.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是__ __。
(本题共10分) 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜:如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。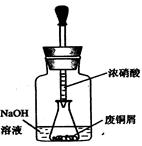
步骤二:碱式碳酸铜的制备:向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
①.上图装置中NaOH溶液的作用是_ _。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有__ __(填写化学式)。
②步骤二中,水浴加热所需仪器有__ __、_ _(加热、夹持仪器、石棉网除外);
洗涤的目的是__ __。
③.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
④.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是__ __。
(共10分)用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、50 mL烧杯、 mL容量瓶,若要完成实验,还需要两种玻璃仪器为: 、 。
⑵请写出该实验的实验步骤:
①计算,②称量 gNaCl, ③溶解,④移液,⑤ ,⑥ ,⑦ 摇匀。
⑶ 试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度:
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度:
③定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度:
④另一同学准确配制溶液后,从中取出25ml,其中NaCl的物质的量浓度为 。
(本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
1.制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com