
题目列表(包括答案和解析)
| |||||||||||||||
教材实验设计也常存在不足,在学习过程中对其进行改进是研究性学习的一个重要课题。
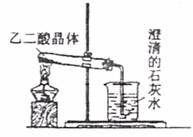
Ⅰ.草酸晶体(H2C2O4?2H2O)受热易分解(分解温度为175℃),产生CO和CO2。上图为高三教材82页关于草酸晶体受热分解及验证部分分解产物的实验装置图。
(1)写出草酸晶体受热分解的化学方程式: 。
(2)该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g?cm-3 | |
| 草酸晶体 | H2C2?2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有同学认为,用该装置进行实验,存在不合理因素,请分析指出(任答两点):
① 。
② 。
Ⅱ.下图甲是高一课本65页“铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性:
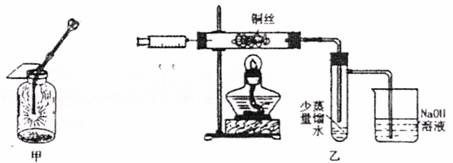
②取下注射器并集满C12;
③点燃酒精灯加热1―2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将C12缓缓推入玻璃管中;
④拔出针头,再用同样的方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入C12时,观察到铜丝继续保持红热状,由此可判断,反应为 反应(填“放热”或“吸热”)
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动针栓,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离子方程式为 。
(3)改进生的实验与课本实验相比较,其优点为 。
(08厦门市质检)教材实验设计也常存在不足,在学习过程中对
 其进行改进是研究性学习的一个重要课题。
其进行改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4?2H2O)受热易分解(分解温
度为175℃),产生CO和CO2。右图为高三教材82
页关于草酸晶体受热分解及验证部分分解产物的实验
装置图。
(1)写出草酸晶体受热分解的化学方程式:
。
(2)该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g?cm-3 |
草酸晶体 | H2C2O4?2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有同学认为,用该装置进行实验,存在不合理因素,请分析指出(任答两点):
① 。
② 。
Ⅱ.下图甲是高一课本65页“铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
|
①按上图乙所示连接好装置,并检查气密性:
②取下注射器并集满C12;
③点燃酒精灯加热1―2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将C12缓缓推入玻璃管中;
④拔出针头,再用同样的方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入C12时,观察到铜丝继续保持红热状,由此可判断,该反应为 反应(填“放热”或“吸热”)
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动针栓,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离子方程式为 。
(3)改进后的实验与课本实验相比较,其优点为 。
(15分)镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是 镁原子电子式
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是 (不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg> Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④ 通过观察某种实验现象得到结论,该实验现象是
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg> Al”
甲试管现象
乙试管离子方程式
实验三:利用原电池原理也可得出“金属性:Mg> Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg>Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
(15分)镁、铝是生活中两种常见的金属,课堂上老师演示了系列关于镁、铝性质的实验,某学习小组在组长的带领下进行归纳整理,并进行了深入的思考。
(1) “位置和结构”
①铝元素在周期表的位置是 镁原子电子式
(2) “基本性质”
②下列关于镁、铝及其化合物性质的说法,正确的是 (不定项选择)
A.镁在氯气中剧烈燃烧,产物中只有离子键
B.电解熔融的Al2O3可以制备金属铝
C.Al和MgO按照适当比列混合可做“铝热剂”,发生“铝热反应”
D.铝片放入冷的浓硝酸中,无明显现象,未发生化学反应
(3)设计实验验证“金属性:Mg > Al”
实验一:截取一段大小和形状相同的“经过一定预处理”的镁片和铝片,放入试管中,同时加入浓度和体积均相同的盐酸,观察某种实验现象,得到结论“金属性:Mg > Al”
③镁片和铝“经过一定预处理”,下列实验操作达到“预处理”效果的是
A.用砂纸打磨镁片和铝片
B.用盐酸浸泡镁片和铝片片刻
C.用烧碱溶液浸泡镁片和铝片片刻
④通过观察某种实验现象得到结论,该实验现象是
实验二:如右图,甲乙试管中分别加入2ml 1mol/L MgCl2和AlCl3溶液,用胶滴管逐滴滴加5mol/L NaOH溶液至过量。
⑤该“对照实验”甲、乙试管中分别出现实验现象能得出“金属性:Mg > Al”
甲试管现象
乙试管离子方程式
实验三:利用原电池原理也可得出“金属性:Mg > Al”,
⑥请在右框中画出一个原电池装置图,能够通过观察实验现象判定金属性:Mg >Al
可用材料:镁片、铝片、导线,其它试剂和材料、仪器可自选。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com