
题目列表(包括答案和解析)
| 1 |
| 2 |
| 1 |
| 2 |
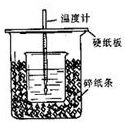

 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 |
起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||

 记录液面刻度的读数;
记录液面刻度的读数; 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL| 加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
| 过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
| pH | 1.00 | 2.28 | 3.30 | 7.00 | 9.70 | 11.70 | 12.50 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com