
题目列表(包括答案和解析)

| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(F)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
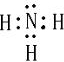


 cC+dD已知生成物C是固体,当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时反应达到化学平衡.
cC+dD已知生成物C是固体,当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时反应达到化学平衡.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com