
题目列表(包括答案和解析)
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |


| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |

(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。

(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液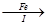 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
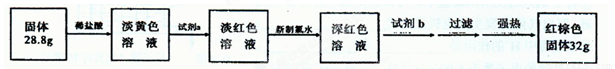
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液![]() FeSO4溶液
FeSO4溶液![]() FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。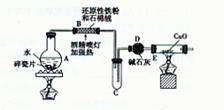
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液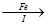 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。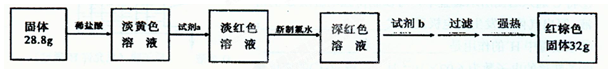
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com