
题目列表(包括答案和解析)
为了制取碘,可通过反应:2NO+O2==2NO2 NO2+2H+ +2I- ==NO + I2+H2O制得,NO在制碘过程中的作用是
A.还原剂 B.氧化剂 C.催化剂 D.反应物
【解析】根据反应观察可知反应前后NO的的量并没有发生变化,但参与了化学反应,所以起催化剂作用,答案是C。
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是
A.2:3 B.3:2 C.4:3 D.1:3
【解析】根据反应前后的元素的化合价变化可判断,N元素由-3价升高到0,即氮气是氧化产物,每生成1mol氮气转移6mol电子。Pt的化合价由+4价降低到0价,所以Pt是还原产物。根据得失电子守恒可知生成铂的物质的量是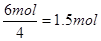 ,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
Mg、Cu合金8.4g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480mLNO2和2240mLN2O4,反应后的溶液中加足量的NaOH溶液,生成的沉淀再经灼烧后所得固体质量为:
A.15.2 g, B.11.6g C.13.5g, D.16.6 g
【解析】根据反应过程不难判断,生成的沉淀是氢氧化镁和氢氧化铜,灼烧得到的是氧化镁和氧化铜,因为金属每失去2mol电子,就要结合1mol氧原子。硝酸的还原产物是NO2和N2O4,转移的电子是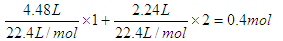 ,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
最近,科学家用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相类似。该化学反应是:
A.H2O+CH3COOH 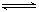 H3O++CH3COO-
H3O++CH3COO-
B.Zn+2HCl = ZnCl2+H2↑
C.CO2+2NH3 = CO(NH2)2+H2O
D.NH3+HCl = NH4Cl
【解析】根据反应的特点可以判断类似于氯化铵的生成,因为氨气获得1个质子生成NH4+,NH4+和氯离子结合生成氯化铵,所以答案是D。
为了制取碘,可通过反应:2NO+O2==2NO2 NO2+2H++2I- ==NO + I2+H2O制得,NO在制碘过程中的作用是
A.还原剂 B.氧化剂 C.催化剂 D.反应物
【解析】根据反应观察可知反应前后NO的的量并没有发生变化,但参与了化学反应,所以起催化剂作用,答案是C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com