
题目列表(包括答案和解析)
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA
C.7.8gNa2O2中含有的阴离子数等于0.1NA
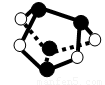
D.0.5mol雄黄(As4S4,结构如图)含有NA个S—S键
根据要求填空:
(1)在0.1mol/L的CH3COOH溶液中,若加入少量的蒸馏水,溶液的pH ;若加入少量的纯醋酸,溶液中的c(CH3COO—) ;若加入少量的NaOH固体,溶液中的c(H+) ;若加入少量的CH3COONa固体,溶液中的c(OH—) 。(以上均用“增大”、“减小”或“不变”填空)
(2)在以KOH为电解质溶液的氢氧燃料电池中,电池工作时其负极的电极反应式为 正极的电极反应式为 。
下列溶液中有关物质的量浓度关系和计算不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
B.已知25°C时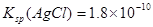 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到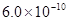 mol·L-1
mol·L-1
C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有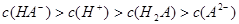
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com