
题目列表(包括答案和解析)
(8分)请选择合适方法的字母代号填空:
(1)从煤焦油中提取二甲苯________;
(2)从海水中提取粗盐________;
(3)十六烷转变为辛烷和辛烯________;
(4)轻柴油转变为乙烯、丙烯等不饱和烃________;
(5)煤转化为焦炭、煤焦油等________;
(6)工业上由氧化铝制取金属铝________;
(7)从铁矿石中提取金属铁________;
(8)提纯氢氧化铁胶体(除去其中的杂质离子)________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原 G.电解 H.溶解
I.渗析 J.蒸发 K.氧化
(7分) 科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。

⑶根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:

进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知

则
(1)同位素种类由______________决定。
(2)元素种类由______________决定。
(3)某元素有无同位素由______________决定。
(4)核素相对原子质量由______________决定。
(5)主族元素的化学性质主要由______________决定。
(6)核电荷数由______________决定。
(7)碱金属原子失电子能力相对强弱由______________决定。
(8)原子得失电子能力相对强弱由______________决定。
在1 L密闭容器中发生反应:4NH3(g)+5O2(g)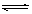 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.7 |
1.475 |
0.1 |
|
第10min |
0.7 |
1.475 |
0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
在1 L密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com