
题目列表(包括答案和解析)
生活饮用水水 质的标准主要有:色度、混浊度、pH、细菌总数、嗅和味等等。目前城市自来水处理过程中所使用的主要药剂仍是Cl2(消毒剂)和Al2(SO4)3(沉降剂),但由于种种原因,用这两种物质处理水质,总有缺陷。因此,有资料报道:Na2FeO4是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+离子,使用该物质可代替Cl2和Al2(SO4)3
(1)配平工业上制备铁酸钠的化学方程式:

(2)当反应物中含有1.4mol钠离子,上述反应恰好完全进行时,电子转移总数为____NA。
(3)Na2FeO4代替Cl2是因为它具有__________性,还原为Fe3+后净水的原理为(用离子方程式表示)_________
(4)某厂制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中
①NaCl ②NH4Cl ③KMnO4 ④浓H2SO4,能使NaNO2转化为N2(不引起二次污染的)是______(选填编号),反应离子方程式___________________________
(15分)
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d.不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
A.将水加热煮沸 B.加入适量的Na3P04
C.加入过量的稀盐酸 D.将水通过磺化煤
(4)工业上采用硫化钠一石灰铁盐法除去含砷废水(砷的主要存在形式为H3ASO3的主要工艺
流程如下
已知:a.亚砷酸(H3As03)还原性较强,易被氧化为砷酸(H3AsO3)
B.亚砷酸盐的溶解性大于相应的砷酸盐
请回答以下问题:
①废气的主要成分为____
②写出一级沉砷过程中生成雌黄的离子方程式:______
③滤渣B的主要成分有_____〔写两种,用化学式表示)
 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
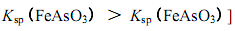

 Bi(HDz)3+3H+],再经萃取把金属离子从水溶液中分离出来。设常温时该反应的化学平衡常数为K,则当pH=3时废水中c(H2Dz)等于________mol/L(用K表示)。
Bi(HDz)3+3H+],再经萃取把金属离子从水溶液中分离出来。设常温时该反应的化学平衡常数为K,则当pH=3时废水中c(H2Dz)等于________mol/L(用K表示)。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com