
题目列表(包括答案和解析)
38.4mg铜与适量的浓硝酸反应,铜全部作用后,共收集到22.4mL(标准状况)气体,反应消耗硝酸的物质的量可能是[设反应后的气体产物中无N2O4]( )
A.1.0×10-3mol B.1.6×10-3mol C.2.2×10-3mol D.2.4×10-3mol
A.1.0×10-3mol B.1.6×10-3mol C.2.2×10-3mol D.2.4×10-3mol
A.1.0×10-3mol B.1.6×10-3mol C.2.2×10-3mol D.2.4×10-3mol
X、Y和W为原子序数依次递增的短周期元素。已知:X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
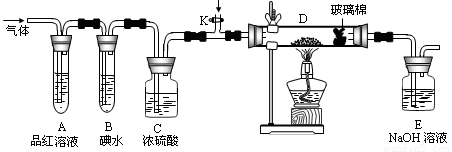
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铜粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 。
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙 E.双氧水 F.硝酸银
X、Y和W为原子序数依次递增的短周期元素。已知:X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铜粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒(催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 。
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com