
题目列表(包括答案和解析)


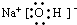
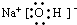
 H++HO2ˉ
H++HO2ˉ H++HO2ˉ
H++HO2ˉ| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |


| YO2 | YO3 | |
| 空气 | 94%~95% | 5%~6% |
| 氧气 | 97%~98% | 2%~3% |
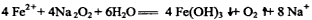 ,则下列说法正确的是
,则下列说法正确的是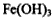 ,还原产物是O2
,还原产物是O2 ,还原剂是
,还原剂是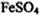
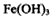 时转移6 mol电子
时转移6 mol电子 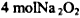 完全反应时转移8 mol电子
完全反应时转移8 mol电子 下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
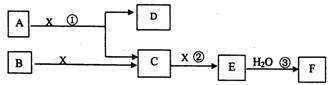
(1)A的化学式为___________________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子
_________________mol。
(3)写出D与铝单质反应的化学方程式______________________。
(4)反应②是可逆反应,在2L的密闭容器中投入4molC和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是___________(填写序号字母)。
A. 工业制取F时,C和X生成E的反应是在吸收塔进行
B. 这10分钟内,X的平均反应速率是0.lmol/(L?min)
C. 当C和X的消耗速率比为2:1时,标志着反应达到平衡
D. 平衡时C的转化率是50%
E. 在工业生产中可以通过增加X浓度来提高C的转化率
F. 工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
_______________________________________________________。
(6)将5mL0.02mol/L的F溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是___________。
阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com