
题目列表(包括答案和解析)
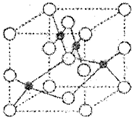



将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为电能
C.NaOH溶液的浓度约是1.5mol/L
D.该实验表明有水生成的反应都是放热反应
【解析】温度为22℃对应的盐酸的体积是5ml,即该温度是反应后溶液的温度,因此环境温度一定低于22℃.只有当二者恰好反应时放出的热量才最多,溶液的温度才最高,根据图像可判断当盐酸的体积是30ml时温度最高,所以氢氧化钠的浓度是![]() ,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com