
题目列表(包括答案和解析)
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
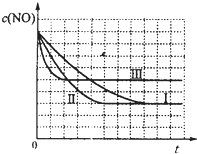
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| ① | 350 | 1.20×10-2 | 5.80×10-2 | 124 |
| ② | 280 | 1.20×10-2 | 5.80×10-2 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| NO | N2 | CO | |
| 起始浓度mol.L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.04 | 0.03 | 0.03 |
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。

(15分)氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。请回答下列问题:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应探究脱氨原理。
①用适量0.1mol L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
②将KNO3溶液的pH调至2.5;
③向②调节pH后的KNO3溶液中持续通入一段时间N2,目的是 。
④用足量Fe粉还原③处理后的KNO3溶液。充分反应后,取少量反应液,加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,请根据以上信息写出Fe粉和KNO3溶液反应的离子方程式__。
(2)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中氧化剂与还原剂的物质的量之比为 。
(3)常温下向含0.01 mol HCl的溶液中缓缓通入224 mLNH3(标准状况,溶液体积变化忽略不计)。
①在通入NH3的过程中,溶液的导电能力 _________ (填“增强”、“减弱”或“基本不变”),理由是 ;水的电离程度 (填“增大”、“减小”或“基本不变”)。
②向HCl和NH3完全反应后的溶液中继续通入NH3,所得溶液中的离子浓度大小关系可能正确的是 (填字母编号)。
a.c(H+)>c(C1-)>c(OH-)>c(NH4+) b.c(NH4+)>c(C1-)>c(H+)>c(OH-)
c.c(NH4+)>c(H+)>c(C1-)>c(OH-) d.c(C1)=c(NH4+)>c(H+)=c(OH-)
 L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com