
题目列表(包括答案和解析)
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约l min后鼓入空气.请填写下列空白:

(1)检验乙醛的试剂是________;
A、银氨溶液
B、碳酸氢钠溶液
C、新制氢氧化铜
D、氧化铜
(2)乙醇发生催化氧化的化学反应方程式为________;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是________,由于装置设计上的缺陷,实验进行时可能会________;
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示.

试解释鼓气速度过快,反应体系温度反而下降的原因:__________,该实验中“鼓气速度”这一变量你认为可用________来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色.该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确?________.
某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设: 。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出。
你认为合理的方案是(填字母) 。
(2)乙小组针对甲小组的假设,另设计如下图装置进行验证。

若按乙组装置定性检验上述红色沉淀成分,可根据 现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量
(填序号)。
①通入氢气的体积;
②反应前红色沉淀和硬质玻管的总质量;
③完全反应后红色固体和硬质玻璃管的总质量;
④实验前干燥管质量;
⑤硬质玻璃管质量;
⑥锌粒质量;
⑦稀硫酸中含溶质的量;
⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有
(请写出两点)。
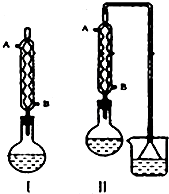 由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:| 浓H2SO4 |
| △ |
| ||
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com