
题目列表(包括答案和解析)
| 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A∶C | B∶A | D∶E | B∶E |
1∶1 | 1∶2 | 1∶3 | 1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2个。在周期表中,C是E的邻族元素,化学性质活泼,D和E则位于同一周期,D和E的原子序数之和为30。
(1)写出元素符号:A___________,B___________,C___________,D___________,E___________。
(2)向甲的水溶液中加入MnO2,反应的化学方程式是____________________________。
(3)已知乙的式量小于甲,在实验室中常用什么方法制得乙:______________________
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式为______________________。
(5)向3 mL 1 mol·L-1KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸;②0.5 mL 30%甲溶液;③1 mL丁。经充分振荡后静置,可得到紫色溶液,这种紫色溶液是___________。
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。

①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若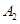 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若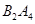 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
甲 乙 丙 丁
化合物中各元素原子个数比 A:C=1:1 B:A=1:2 D:E=1:3 B:E=1:4
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多两个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)试推断出各元素的符号:A ;B ;C ;D ;E 。
(2)E元素位于周期表中第 周期 族,其最简单离子的结构示意图为 ,E的最高化合价为_____价。
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是____(元素符号),并写出反应的离子方程式:_________________、_________________。
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。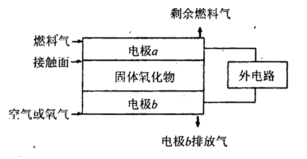
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若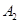 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若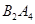 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com