
题目列表(包括答案和解析)
下列物质
:(1)[ ]
A.(1)(3)(5) B.(2)(4)(6) C.(1)(6)(7) D.(2)(5)(7)
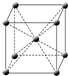
下列物质:①二氧化硅 ②晶体硅 ③金刚石 ④甲烷 ⑤铵根离子 ⑥三氯甲烷⑦氨分子 其中晶体或分子的空间结构不属于正四面体的是
[ ]

 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | |||||||||||||||||
| M |
| 2a3NA |
| M |
| 2a3NA |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com