
题目列表(包括答案和解析)
【解析】A项电荷守恒等式为:c(H+)+c(Na+)=c(OH-)+c(HSO3-)+c(HCO3-)+2c(CO32-) +2c(SO32-),溶液呈中性,c(H+)=c(OH-),导出c(Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-),A项不正确。
B项中的电荷守恒式为:c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-),溶液呈中性,c(H+)=c(OH-),导出c(Na+)=c(Cl-)+c(CH3COO-);根据物料守恒有c(Na+)=c(CH3COOH)+c(CH3COO-),由此二式导出c(Cl-)=c(CH3COOH),综上所述,有c(Na+)>c(Cl-)=c(CH3COOH),B项不对
C项中,NH4+水解呈酸性,CO32-水解呈碱性,它促进NH4+的水解;Fe2+水解呈酸性,它抑制NH4+的水解,所以三种溶液中c(NH4+):③>②>①,C项正确。
D项中,盐类的水解促进水的电离,强酸和弱酸都会抑制水的电离,当c(H+)相同时,对水的电离产生的抑制作用相同,正确的顺序应为①>②=③,D项不对。
【答案】C
下列离子方程式中书写正确的是( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2++OH-+H++SO42-= BaSO4↓+H2O
B. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-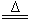 NH3↑+H2O
NH3↑+H2O
C. 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-= 3 Fe3++2 NO↑+4 H2O
D. KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2
【解析】A中没有配平,正确是Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O。B中还有碳酸钾生成,C中铁过量,生成物应是亚铁离子,所以正确的答案是D。
将充满20mLNO的试管倒置于盛有蒸镏水的烧杯中,然后向试管里通入纯氧气,当试管内液面稳定在试管容积的4/5时,则通入O2为可能 ( )
A.9mL B.15mL C.19mL D.31mL
【解析】NO和O2在水中反应的方程式为4NO+3O2+2H2O=4HNO3。若NO过量,则参加反应的NO是16ml,消耗氧气是12ml。若氧气过量,20mLNO消耗的氧气是15ml,剩余氧气是20ml×1/5=4ml,所以通入的氧气是19ml,答案选C。
实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
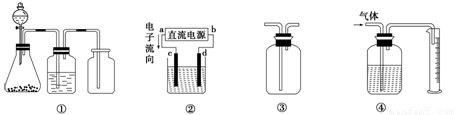
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸反应制取气体
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
【解析】铜屑与稀硝酸反应制取的气体是NO,NO不能用排气法收集,A错误。再电池中电流是从正极流向负极,电子是从负极流向正极,所以a是负极,b是正极,B不正确。若用来测量气体体积。则试剂瓶中必须装满水,D不正确。选项C中若收集密度大于空气的,则长进短出,若收集密度小于空气的,则短进长出,所以答案是C。
为了制取碘,可通过反应:2NO+O2==2NO2 NO2+2H+ +2I- ==NO + I2+H2O制得,NO在制碘过程中的作用是
A.还原剂 B.氧化剂 C.催化剂 D.反应物
【解析】根据反应观察可知反应前后NO的的量并没有发生变化,但参与了化学反应,所以起催化剂作用,答案是C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com