
题目列表(包括答案和解析)

 I2+O2+H2O
I2+O2+H2O I2+O2+H2O
I2+O2+H2O


| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高
| ||
| ||
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.0.3mol NO2气体溶于足量水中充分反应转移的电子总数为0.2 NA
B.7.8g Na2O2固体中含有的离子总数为0.4NA
C.标准状况下,22.4L SO3与足量水充分反应生成的H+的总数为2NA
D.0.5mol Fe与过量的硫在加热的条件下充分反应得到的电子总数为1.5NA
【解析】NO2气体溶于的方程式为3NO2+H2O=2HNO3+NO在反应中NO2既是氧化剂还是还原剂,转移的电子数是2,所以A正确。过氧化钠中阳离子和阴离子的个数之比是2︰1,所以7.8g Na2O2固体中含有的离子总数为0.3NA,即B不正确。标准状况下三氧化硫不是气体,C不正确。铁与稀硫酸反应生成的是亚铁离子,即0.5mol Fe失去的电子是1mol,D不正确。答案选A。
下列离子方程式中书写正确的是( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2++OH-+H++SO42-= BaSO4↓+H2O
B. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-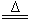 NH3↑+H2O
NH3↑+H2O
C. 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-= 3 Fe3++2 NO↑+4 H2O
D. KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2
【解析】A中没有配平,正确是Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O。B中还有碳酸钾生成,C中铁过量,生成物应是亚铁离子,所以正确的答案是D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com