
题目列表(包括答案和解析)
(08上海12校第二次联考)右图中的两条曲线分别代表的是:1gC3H6
和1gM气体在相同体积的容器中,测得容
器中的压强和温度的关系,试根据图形判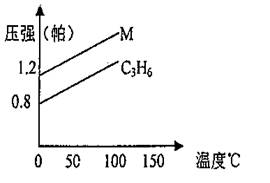
断M气体可能是 ( )
A.C3H8 B.C2H4
C.H2S D.N2O4

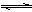 3C(g),如下图所示的甲、乙分别表示在不同的条件下生成物C在反应混合物中的体积分数和反应时间的关系图,按下述要求填写答案,并简述判断的理由。
3C(g),如下图所示的甲、乙分别表示在不同的条件下生成物C在反应混合物中的体积分数和反应时间的关系图,按下述要求填写答案,并简述判断的理由。
现有可逆反应:A (g)+B(g)![]() 3C(g),下图中甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间的关系:
3C(g),下图中甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间的关系:
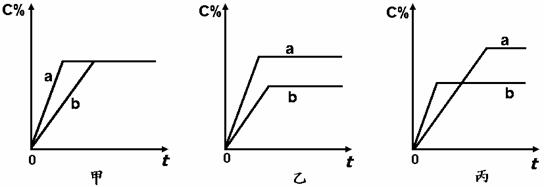
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则 曲线表示有催化剂的情况。
(2)若乙图中的a曲线分别表示200℃时的情况,b曲线表示100℃的情况,则此可逆反应的正反应是 (填“吸热反应”或“放热反应”)。
(3)若丙图中的两条曲线分别表示不同压强情况,则 曲线是表示压强较大的情况。
 C(g);ΔH = a kJ/mol。图中的两条曲线分别表示200℃和300℃时,体系中B的百分含量和时间t的关系。下列说法中正确的是
C(g);ΔH = a kJ/mol。图中的两条曲线分别表示200℃和300℃时,体系中B的百分含量和时间t的关系。下列说法中正确的是 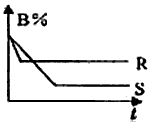
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com