
题目列表(包括答案和解析)
 复习电化学知识后,某学生设计了一个“黑笔写彩字”的趣味实验.滤纸先用某混合溶液浸湿,然后平铺在一块铂片上,右端是C、Cu两电极浸入氯化铁溶液中,电路接通后,用铅笔在滤纸上写字,会出现彩色字迹.据此判断电极材料与反应现象均正确的是 复习电化学知识后,某学生设计了一个“黑笔写彩字”的趣味实验.滤纸先用某混合溶液浸湿,然后平铺在一块铂片上,右端是C、Cu两电极浸入氯化铁溶液中,电路接通后,用铅笔在滤纸上写字,会出现彩色字迹.据此判断电极材料与反应现象均正确的是( )
|
| 1 | 2 |

工业制硫酸时,利用催化氧化反应将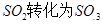 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下, 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol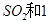 mol
mol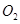 ,发生反应:
,发生反应: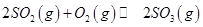 ,达平衡后改变下述条件,
,达平衡后改变下述条件,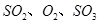 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol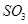
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1mol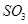
D.移动活塞压缩气体
E.升高温度
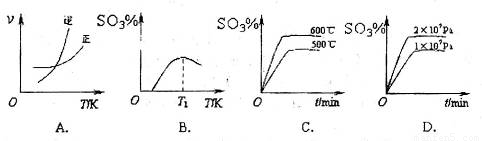
(3)下列关于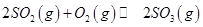 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol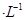 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
下列有关电化学知识的描述正确的是
A.CaO+H2O== Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
下列有关电化学知识的描述正确的是
A.CaO+H2O== Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com