
题目列表(包括答案和解析)
黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O =SO42-+ 2Fe2++ 4H+
Cr2O72-+ 6 Fe2+ + 14 H+=2 Cr3+ + 6 Fe3+ + 7 H2O
⑴①黄铁矿煅烧的化学方程式为: 。
②样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: ___________________________________________。
⑶煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_____________L,制得98%的硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是 kJ。
(4)硫酸的用途非常广泛,请写出用之制取“普钙”的化学方程式并用最简洁的语言解释为什么这种化肥不能与草木灰混合施用: ;
、 。
黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O =SO42-+ 2Fe2++ 4H+
Cr2O72-+ 6 Fe2+ + 14 H+=2 Cr3+ + 6 Fe3+ + 7 H2O
⑴①黄铁矿煅烧的化学方程式为: 。
②样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: ___________________________________________。
⑶煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_____________L,制得98%的硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是 kJ。
(4)硫酸的用途非常广泛,请写出用之制取“普钙”的化学方程式并用最简洁的语言解释为什么这种化肥不能与草木灰混合施用: ;
、 。
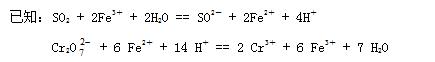
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
(14分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O ="=" SO2- + 2Fe2+ + 4H+
Cr2O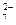 + 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________________。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:______________________________________________________________________。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
已知:SO2+2Fe3++2H2O=![]() +2Fe2++4H+
+2Fe2++4H+
![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com