
题目列表(包括答案和解析)
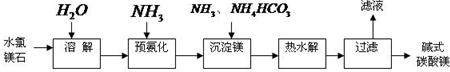
| 1 |
| 2 |
| 1 |
| 2 |
下列离子方程式书写不正确的是
A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,
4OH- + 3SO2 = SO32-+ 2HSO3- + H2O
B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2--= CuS↓
C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,
2Fe2+ + 4Br- +3Cl2 = 2 Fe3+ + 2Br2 + 6Cl-
D. 1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
下列离子方程式书写不正确的是
| A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH- + 3SO2 = SO32-+ 2HSO3-+ H2O |
| B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2--= CuS↓ |
| C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2 =" 2" Fe3+ + 2Br2 + 6Cl- |
D.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合: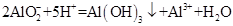 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com