
(2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H
2O
2后,则可使铜溶解.该反应的化学方程式为
Cu+H2O2+2HCl=CuCl2+2H2O
Cu+H2O2+2HCl=CuCl2+2H2O
.某同学未加入氧化剂,而是将它设计成一个电解装置,也能使铜很快溶于稀盐酸.请在方格中画出该装置:
(2)在一定体积的18mol?L
-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积
大于
大于
(填大于、等于或小于)100mL.有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?
可行
可行
(填“可行”或“不可行”).如果可行,用离子方程式说明原因;如果不可行,此问可以不填
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.
(3)将等质量的铜片分别与等体积、过量的浓硝酸和过量的稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu
2+浓度不同引起的,你同意这种看法吗?
不同意
不同意
(填“同意”或“不同意”),原因是
等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,所得溶液中Cu2+的浓度基本相等
等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,所得溶液中Cu2+的浓度基本相等
.另一同学提出溶液呈“绿色”是溶液中Cu
2+与NO
2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:
将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确
将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确
.

 (2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成
(2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成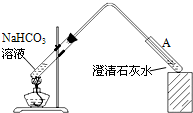 (2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化: (2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题: