(2013?潍坊模拟)某学习小组在实验室以食盐为原料模拟氯碱工业.步骤有①粗盐的提纯、②电解饱和食盐水.具体流程如下:
第一步:粗盐(含
S、Ca2+、Mg2+、K+)的提纯.
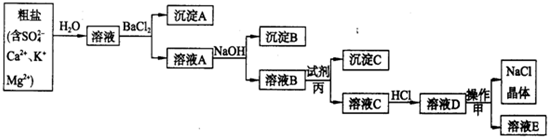
请回答:
(1)试剂丙的化学式为
Na2CO3
Na2CO3
,目的是除去溶液B中的
Ca2+、Ba2+
Ca2+、Ba2+
(写离子符号).
(2)用离子方程式表示溶液C中加入HCl后发生的化学反应:
CO32-+2H+═H2O+CO2↑,H++OH-=H2O,
CO32-+2H+═H2O+CO2↑,H++OH-=H2O,
.
(3)溶液E中含有的离子是
Na+、K+、H+、OH-、Cl-.
Na+、K+、H+、OH-、Cl-.
(写离子符号).
第二步:用提纯后的食盐晶体制备化工产品烧碱和产品甲.
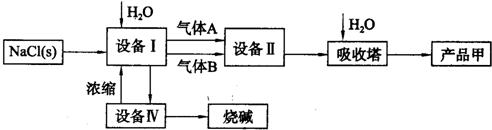
请回答:
(4)设备II内火焰的颜色是
苍白色
苍白色
.其化学反应为
.
(5)设备Ⅰ中电解一段时间后,测得溶液的pH值为13.若以电解100mL.溶液计算(忽略溶液体积的变化),此时阴极产生气体的体积是
112
112
mL.若恢复原溶液的成分和浓度,需要加入
氯化氢
氯化氢
(物质名称)
0.365
0.365
g.
(6)若粗盐不经过第一步的提纯,直接进入第二步中的设备I,设备I中溶液出现的现象是
溶液中出现白色沉淀;
溶液中出现白色沉淀;
.电解时发生反应的离子方程式为
、
2OH-+Mg2+=Mg(OH)2↓
2OH-+Mg2+=Mg(OH)2↓
.

![]() 的水解酸性
的水解酸性![]() 被作物吸收时所显的生理酸性
被作物吸收时所显的生理酸性![]() 代换
代换



