
题目列表(包括答案和解析)
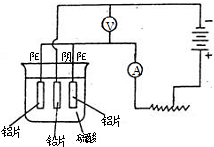 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
| ||
 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照右图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照右图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
 c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
试回答下列问题
(1)用苯和酒精擦拭铝片的目的: ,氢氧化钠溶液处理铝片的目的是: 。
(2)下列有关说法正确的是 (填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+ ![]() 2Al3+ +3H2↑
2Al3+ +3H2↑
(3)阴极的电极反应式为: 。
铝及铝合金经过阳极氧化,铝表面能生成几十微米的较厚的氧化铝膜。

Ⅰ.某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面;
b.用水冲洗经有机物擦洗的铝片,浸入60~70 ℃的2 mol·L-1的NaOH溶液中,以除去原有的氧化膜,约1 min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解;
c.阳极氧化,以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。
试回答下列问题:
(1)用苯和酒精擦拭铝片的目的:_______________________________,
氢氧化钠溶液处理铝片时反应的离子方程式是____________________________________。
(2)阳极的电极反应式为______________________________。
(3)下列有关说法正确的是________(填字母代号)。
A.电解时电子从电源负极→导线→铅极,铝极→导线→电源正极
B.在电解过程中,H+向阳极移动,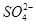 向阴极移动
向阴极移动
C.电解过程中溶液的pH基本不变
D.电解时,铝片为阳极,被氧化
Ⅱ.另一小组针对铝表面保护膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期用来盛放和腌制咸菜。究其原因,该小组设计了一个实验以探究其中的原因。他们的实验过程如下:
|
实验 |
|
|
|
编号 |
实验过程 |
实验现象 |
|
1 |
取一小片铝片于试管中,加入1.0 mol·L-1的盐酸2 mL |
30秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
2 |
取一小片铝片于试管中,加入0.5 mol·L-1的硫酸2 mL |
55秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
3 |
取一小片铝片于试管中,加入氯化铜稀溶液 |
3分钟左右表面产生少量气泡,且铝表面析出一些红色固体 |
|
4 |
取一小片铝片于试管中,加入硫酸铜稀溶液 |
一直没有明显的变化 |
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是________________________________________________________________________。
根据该实验现象,你认为铝制容器不能长期盛放和腌制咸菜的原因是________________________________________________________________________。
| A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极 | ||||
| B.在电解过程中,H+向阳极移动,SO42-向阴极移动 | ||||
| C.电解过程中阳极周围的pH明显增大 | ||||
D.电解的总方程式可表示为2Al+3H2SO4
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com