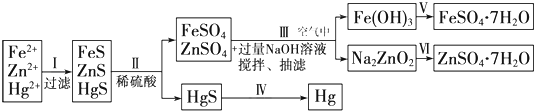
(2009?宿迁模拟)某工厂排出的污水中含有大量的Fe
2+、Zn
2+、Hg
2+三种金属离子.以下是化学研究性学习小组的同学对该厂污水处理的设想.
[资料获悉]部分阳离子以氢氧化物或硫化物形式完全沉淀时溶液的pH及硫化物的K
SP如下表所示.
| 沉淀物 |
Fe(OH)2 |
Zn(OH)2 |
Hg(OH)2 |
| 沉淀完全的pH |
9.7 |
8.0 |
5.3 |
| 沉淀物 |
FeS |
ZnS |
HgS |
| 沉淀完全的pH |
≥4.92 |
≥2.72 |
≥2.5 |
| KSP |
3.7×10-19 |
1.2×10-23 |
4×10-53 |
[探究思路]设想(一):重点是治理污染,低成本除去重金属离子Zn
2+、Hg
2+.
设想(二):除去污水中金属离子,回收绿矾、皓矾(ZnSO
4?7H
2O)和汞.
[药 品]NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉.
[实验探究](1)为了实现设想(一),甲、乙、丙三位同学分别对废水采取以下措施:
甲:加入NaOH溶液,调节溶液pH至10;
乙:加入硫化钠溶液,调节溶液pH至5;
丙:加入硫化亚铁粉末,搅拌.
你认为合理的是
丙
丙
(填“甲”、“乙”或“丙”),理由是
硫化亚铁成本低,使沉淀转化成HgS、ZnS沉淀而除去
硫化亚铁成本低,使沉淀转化成HgS、ZnS沉淀而除去
.
(2)研究性学习小组根据设想(二)设计了如图所示的实验方案.
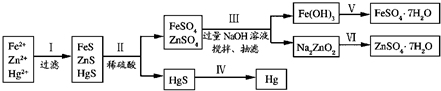
请回答:
①步骤Ⅲ中抽滤的目的是
加快过滤速度
加快过滤速度
,抽滤的主要仪器是
布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.
该步骤涉及反应的离子方程式有Zn
2++4OH
-=ZnO
22-+2H
2O和
4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
.
②欲实现步骤Ⅴ,所需加入的试剂有
稀硫酸
稀硫酸
、
铁粉(过量)
铁粉(过量)
,所涉及的主要操作依次为
溶解
溶解
、过滤、
重结晶
重结晶
.