
题目列表(包括答案和解析)
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |

反应体系中各组分的部分性质见下表:
气体 | 氮气 | 氢气 | 氨 |
熔点/℃ | -210.01 | -252.77 | -77.74 |
沸点/℃ | -195.79 | -259.23 | -33.42 |
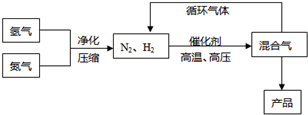
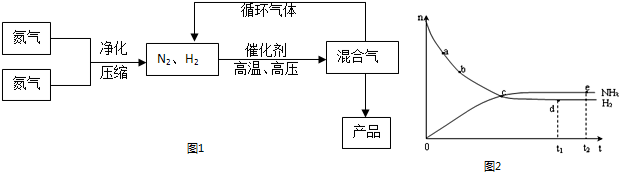
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____________,使混合气体分离出产品,N2、H2继续循环。写出该反应的化学平衡常数表达式:K=____________。
(2)运用化学反应速率和化学平衡的观点说明工业上采用“使混合气体分离出产品,N2、H2继续循环”的生产措施的理由:___________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大
(5)1998年希腊亚里斯多德大学的Marncellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如下图乙。阴极的电极反应式为__________________________________________________________________。


甲 乙
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)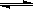 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:

反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com